 TuttoChimica.it
TuttoChimica.it
Chimica, laboratorio e dintorni...

Modelli atomici e configurazione elettronica
Modelli atomici, numeri quantici, la configurazione elettronica
La conoscenza attuale dell'atomo è dovuta a ricerche e brillanti intuizioni che, dalla fine dell'800 si sono evolute verso le conoscenze attuali. Vediamo quali sono le teorie principali, in ordine cronologico.
Modello atomico di Thomson
Secondo la teoria di Thomson del 1897, l'atomo è costituito da una massa sferica di carica positiva in cuii sono incorporati gli elettroni. Questa teoria non riusciva a spiegare molti fatti sperimentali e fu ben presto abbandonata.
Modello atomico di Rutherford
Questa teoria del 1911 vede le cariche positive addensate in un nuclo centrale attorno al quale ruotano, velocissimi per non cader nel nucleo, gli elettroni. Questa teoria non teneva conto del fatto che l'elettrone, secondo le leggi dell'elettrodinamica, essendo una particella carica in moto tende a perdere energia nella sua rotazione, e quindi dovrebbe cadere sul nucleo prima o poi. Tale modello si rivelava quindi instabile.
Modello atomico di Bohr
Niels Bohr applicò all'atomo la teoria dei quanti di Max Planck (del 1925). Secondo questa teoria, l'emissione e l'assorbimento di energia da parte della materia non avviene in qualsiasi misura ma secondo 'pacchetti quantitativi' ben definiti. Vale infatti:
E = h f
dove E è l'energia della radiazione, f la sua frequenza espressa in hertz e h la costante di Planck (6,62 10-34 joule sec).
La teoria di Bohr affermava che gli elettroni si trovavano attorno al nucleo in rotazione lungo orbite ben definite (orbite quantizzate) e che l'emissione e l'assorbimento di energia non avveniva fintanto che si trovavano in queste orbite, ma solo nel momento del passaggio da una di queste orbite ad un'altra in seguito ad una eccitazione (per esempio una radiazione o calore). Secondo Bohr queste orbite erano circolari e tutte concentriche attorno al nucleo, e ogni elettrone occupava una orbita. In condizioni di non eccitazione erano occupate le orbite a minore energia (quelle più vicino al nucleo).
La sua teoria fu ripresa e migliorata da Sommerfeld.
Modello atomico di Sommerfeld
Le novità introdotte da questa teoria furono le segunti:
1) Gli elettroni ruotano in orbite ben definite attorno al nucleo, ma non orbite circolari bensì ellittiche, e il nucleo occupa uno dei due fuochi dell'ellisse.
2) L'elettrone, essendo una carica in movimento, genera un campo magnetico; se l'atomo è posto in un campo magnetico esterno, il piano dell'orbita dell'elettrone subirà uno spostamento nello spazio.
3) L'elettrone oltre a ruotare attorno al nucleo ruota anche su sè stesso: possiede quello che viene definito spin, cioè la rotazione in un senso o nell'altro dell'elettrone attorno al suo asse.
4) La posizione di ogni atomo nel nucleo è caratterizzata da 4 numeri quantici: n, l, m, s. I primi due determinano l'asse minore e l'asse maggior dell'orbita ellittica, il terzo (m) lo spostamento che il piano dell'orbita subisce in un campo magnetico, e il quarto (s) è lo spin, che indica il senso orario o antiorario di rotazione dell'elettrone su sè stesso.
Tutte queste teorie sono state riprese dalla meccanica ondulatoria moderna, infatti consideravano l'elettrone esclusivamente come particella e non anche nella sua duplicità di particella ed onda. Gli studi seguenti, sviluppati da De Broglie, Schroedinger, Heisenberg, Born, Paulie, Fermi e innumerevoli altri studiosi hanno permesso l'attuale teoria atomica:
gli elettroni si muovono a velocità elevatissime attorno al nucleo, in zone dell'atomo ben definite dette orbitali e rappresentate dalla probabilità di trovare in ogni punto dell'orbitale l'elettrone. Non è possibile infatti determinare in un preciso istante in quale punto dell'orbitale si trovi l'elettrone, per il principio di indeterminazione di Heisenberg, ma solo la probabilità che vi si possa trovare.
Ogni orbitale inoltre può essere occupato da un massimo di 2 elettroni con spin tra loro opposto.
Ogni elettrone inoltre ha associata una funzione d'onda, espressa da una complessa equazione matematica, il cui quadrato è appunto la probabilità di trovare l'elettrone in un dato punto. Questa equazione include 3 variabili che sono le stesse n, l e m della teoria di Sommerfeld, inoltre la teoria conferma anche la quarta variabile (s numero di spin)
1) n, detto numero quantico principale, definisce l'estensione e la forma dell'orbitale. Può assumere valori tra 1 e 7.
2) l, numero quantico secondario, definisce la forma possibile per l'orbitale, e per ogni n assume valori che vanno da 0 a n-1. Per n = 2 (secondo orbitale energetico), l avrà valori possibili 0 e 1.
3) m, numero quantico magnetico, definisce l'orientamento dell'orbitale nello spazio, e avrà valori da -l a +l.
4) s, numero quantico di spin, con valori +1/2 o -1/2 a seconda della rotazione oraria o antioraria.
Se due elettroni anno uguali i primi 3 numeri quantici, significa che fan parte dello stesso livello energetico, stesso sottolivello energetico e stesso orbitale. Avranno quindi i due spin opposti (antiparalleli).
Gli elettroni non si distribuiscono a caso negli orbitali, ma secondo alcuni principi:
1) Gli elettroni tendono a posizionarsi negli orbitali a minore energia (principio di Aufbau)
2) Principio di esclusione di Paulie: nello stesso atomo non possono esistere due elettroni con tutti e 4 i numeri quantici uguali.
3) Regola della massima molteplicità di Hund: gli elettroni nello stesso sottolivello energetico (l) si distribuiranno occupando il massimo numero di orbitali possibili disponibili.
I livelli energetici sono indicati quindi dal numero quantico n, possono avere valori 1,2, 3, 4, 5, 6 e 7 (oppure sono indicati anche con le lettere dell'alfabeto, rispettivamente K, L, M, N, O, P, Q.
Per n=1 avremo l=0, quindi un unico sottolivello energetico. Per l=0 il sottolivello (orbitale) è chiamato s, e secondo il numero quantico magnetico, avrà valori da -l a +l, e quindi solo uno, m=0. Questo significa che l'orbitale s ha una unica orientazione nello spazio.
Per l=0 si ha il sottolivello s
per l=1 si ha il sottolivello p
per l=2 si ha il sottolivello d
per l=3 si ha il sottolivello f
Quindi, per n=2 avremo l=0 e l=1, quindi due sottolivelli, s e p, di cui il sottolivello s ha una unica orientazione, mentre il sottolivello p ha 3 possibili orientazioni nello spazio (da - l a +l, quindi -1, 0 e 1. Si indicano generalmente con px, py e pz). Questo significa che il sottolivello p ha 3 orbitali. Analogamente si può vedere che il sottolivello d ha 5 orbitali e il sottolivello f ha 7 orbitali. Lo studio matematico della funzione d'onda ha permesso di risalire alla forma e orientamento nello spazio degli orbitali, dati dalla probabilità di trovare gli elettroni in quel punto attorno al nucleo.
Gli orbitali s hanno forma circolare.
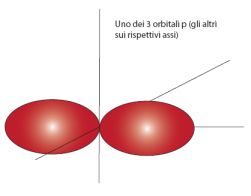
I 3 orbitali p hanno forma di un 8, e sono orientati secondo i 3 assi x y e z, perpendicolari tra loro.
Orbitali d ed f hanno forme complesse costituite da lobi allungati. Poichè ogni orbitale può tenere 2 elettroni, negli orbitali d saranno contenuti fino a 10 elettroni, negli orbitali f fino a 14.

Secondo il principio di Aufbau elencato sopra, gli elettroni si dispongono a partire dagli orbitali a energia inferiore. La scala di energia dei sottolivelli degli orbitali è questa:
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p
Per ricordarne la successione si può utilizzare la regola della diagonale:

La configurazione elettronica:
Per ogni atomo è possibile indicare la relativa rappresentazione della configurazione elettronica nei vari orbitali. Per fare ciò si indicano gli orbitali con un quadrato e gli elettroni con freccie rivolte verso l'alto o verso il basso a seconda dello spin (questa rappresentazione è detta diagramma eletronico o di Lewis). Inoltre, nel riempimento degli orbitali si seguono le regole precedentemente indicate. Gli atomi in ciascun orbitale sono indicati ache con una semplice sequenza di numeri e lettere rappresentanti gli orbitali, con un numero in apice che indica il numero di elettroni. Per il Ferro (numero atomico 26, quindi 26 elettroni):

Come si vede dall'esempio, nell'orbitale d (ultimo riempito secondo la scala energetica data anche dalla regola della diagonale) gli elettroni si dispongono in modo da riempire il numero massimo di orbitali (5 orbitali d) secondo la regola di Hund.
Il diagramma elettronico è molto importante per determinare, per ogni atomo, quanti elettroni si trovano nell'ultimo livello, che ci danno l'indicazione del numero e del tipo di legami che l'atomo potrà formare, in quanto nei legami chimici sono implicati gli elettroni dell'ultimo livello, detti elettroni di valenza. E' detta invece valenza il numero di elettroni spaiati che l'atomo ha, e che sono utilizzati per formare legami con altri atomi (gli atomi cosiddetti gas nobili o inerti, come l'Elio, hanno l'ultimo livello completo e la loro valenza è 0, per questo non reagiscono con gli altri atomi). Ad esempio, per l'ossigeno (numero atomico 8) la configurazione elettronica è:
1s2 2s2 2p4
pertanto sono 6 gli elettroni nell'ultimo livello. Questi si rappresentano con dei puntini attorno al simbolo chimico dell'atomo, a coppie se l'orbitale comprendeva due elettroni di spin antiparallelo, o singoli se l'orbitale comprendeva un singolo elettrone spaiato (simboli di Lewis). Gli elettroni spaiati (per l'ossigeno la valenza è 2 perchè sono 2 gli elettroni spaiati) sono i principali responsabili dei legami, in quanto tenderanno più facilmente degli altri elettroni dell'ultimo livello ad accoppiarsi con un altro elettrone spaiato di un altro atomo.
![]()
Nell'ossigeno due atomi si accoppaino a dare la molecola di O2 mettendo in comune i due elettroni spaiati e formando due legami. Si parla di regola dell'ottetto, secondo cui gli atomi cercano di raggiungere la stabilità e di completare il loro ultimo livello, nel caso dell'ossigeno di avere 8 elettroni nell'ultimo livello, mettendo in comune gli elettroni spaiati con altri atomi.
![]()
Nella molecola d'acqua, l'ossigeno invece si lega a 2 atomi di H, che possiedono un unico elettrone spaiato (1s1) e raggiunge l'ottetto in questo modo. Gli atomi di H invece sono stabili completando il loro ultimo livello, che può tenere solo 2 atomi.
Per il Carbonio invece si ha un caso particolare: la sua configurazione elettronica è
1s2 2s2 2p2
Gli elettroni di valenza sono 4, ma C al momento di viene rappresentato in questo modo:
![]()
In quanto uno dei due elettroni dell'orbitale 2s2
assume uno stato eccitato passando a riempire il terzo orbitale p vuoto. Quindi il C potrà formare 4 legami per raggiungere l'ottetto (questo è
alla base di tutta la chimica organica, la chimica del carbonio).
Categorie Articoli e Appunti
• Chimica Generale
•
Chimica Analitica
•
Chimica Inorganica
•
Chimica Organica
•
Biochimica
•
Biologia
•
Genetica